تاریخچه و مقدمه ریل تایم پی سی آر( Real-time PCR)
همانطور که از معنی واژه بر می آید مفهوم Real time PCR مشاهده لحظه به لحظه یک فرایند می باشد. مشکلات و نواقص موجود در End point PCR همراه با نیاز به یک روش تعیین کمی دقیق زمینه گشایش عرصه ای نوین در تکنیک PCR گردید. فرمول بندی Real-time PCR ابتدا توسطHiguchi و همکارانش به انجام رسید. در این سیستم تشخیصی یک مادۀ فلورسانت درطی واکنش متناسب با میزان محصولات هر سیکل آزاد می شود و میزان فلورسنت آن توسط یک نمایانگر شناسایی و ثبت می گردد.
از زمان معرفی روش PCR، این متد تحولات بسیاری را پیدا نمود. هم اکنون بعنوان یکی از دقیق ترین و سریع ترین روشهای تشخیصی در بسیاری از عرصه های علوم زیستی به کار گرفته می شود. محققین شیوه ای را طراحی نمودند که به جای بررسی محصول PCR با استفاده از روش الکتروفورز، محصول واکنش با استفاده از مواد نشانه گذاری شده ردیابی شود.
تعدادی از مزایای روش Real time PCR
. امکان مانیتورینگ لحظه به لحظه واکنش فراهم آمده و در هر سیکل امکان بررسی فرآیند تکثیر وجود دارد.
- امکان بهینه سازی واکنش با مناسب ترین غلظت DNA و پرایمر
- امکان قطع واکنش در زمان دلخواه که معمولاً اگر بعد از سیکل مورد نظر تکثیر انجام نشد و یا اختلالی در واکنش بود از اتلاف وقت جلو گیری شود.
- سرعت بیشتر در انجام واکنش نسبت به روش End Point
- قابلیت مشخص کردن سیکل دقیق شروع تکثیر
- استفاده نکردن از ژل آگارز برای مشاهده تکثیر محصول PCR و به کار گیری منحنی ذوب
تعدادی از کاربردهای روش Real time PCR
. بررسی بیان ژنهای مختلف
- کنترل کیفی محصولات غذایی از نظر میزان آلودگی میکروبی
- تعیین Copy Number که برای بیماریهایی استفاده می شود که تعداد کپی مهم است.
- ژنوتایپینگ
- تعیین میزان کم پاتوژن ها مانند: HIV برای درمان افراد در مراحل اولیه
- بررسی میزان آنزیم های کبدی
- تشخیص پلی مورفیسم
کلیات اصول نور و فلورسانس Real time PCR
هرماده با توجه به خصوصیات ساختاری و آرایشی و اربیتالی الکترونهای فعال آن، می تواند طیف خاصی از نور را جذب نماید و برای جذب بعضی از طول موج ها تمایل بیشتری نشان می دهد که به این حالت برانگیختگی (Excitation) می گویند.
مولکولهای برانگیخته شده به دو طریق به حالت عادی برمیگردند:
- . برخورد با مولکولهای دیگر که در این حالت برانگیختگی به انرژی جنبشی و گرما تبدیل می شود.
- . توسط بازتابش، به صورت فلورسانس انرژی اضافی خود را مصرف و به آن (Emission) می گویند.
ماده ای که این توانایی را در بررسی و بازتابش پرتو نوری دارد فلورسنت می گویند.
بعضی مولکولها که به هنگام جذب یک فوتون، در طول موج بالاتر از خود نشری را نشان می دهند، که به آنها فلورسانس گویند.
در هنگام نشر فلورسانس نه تنها یک طول موج ویژه ساطع می شود، بلکه مجدداً طیفی متشکل از مجموعه مختلف فوتونها با اندازه مختلف تولید می شود.
انرژی نور تنها هنگامی جذب می شود که مولکول بتواند از سطح انرژی پایین تر به سطح انرژی بالاتر انتقال یابد.
هر ماده دارای یک طول موج تحریک است، که در آن ماده قادر است در یک طول موج خاص بیشترین جذب را داشته باشد.
انواع روشهای Real time PCR
روشهای رایج نشانه گذاری در Real time PCR به دو دسته کلی تقسیم می شوند:
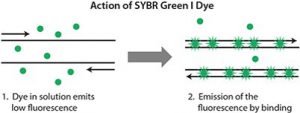
- روشهای مبنی بر استفاده از رنگ های متصل شونده به DNA : دراین روش از رنگ هایی بر پایه SYBR Green یا Eva Green استفاده می شود که این رنگ از طریق جایگزینی در شکاف کوچک به DNA متصل می شود، که به این روش غیر اختصاصی می گویند.
- روشهای مبنی بر استفاده از پروب ها: در این روش با استفاده از انواع پروب میزان حساسیت و اختصاصیت افزایش می یابد، که به این روش روش اختصاصی می گویند.
روش غیر اختصاصی Real time PCR
- . روش غیر اختصاصی:
- مزایای این روش ارزان و راحت بودن است.
- معایب آن که بسیار در این روش شایع است اتصال به دو رشته ای هایی مثل پرایمردایمر و باندهای غیر اختصاصی است.
برای اینکه این مشکل در روش غیر اختصاصی رفع شود باید در زمان اپتیمایز کردن کاری کرد که پرایمردایمر و محصول غیر اختصاصی به میزان حداقل ایجاد شود. بنابراین برای تایید نتایج باید منحنی ذوب (Melt Curve) را آنالیز نمود.
در شکل زیر مشخص است که در واکنش PCR هنگامی که DNA بصورت واسرشت (Denaturation) است، SYBR Green به DNA متصل نمی باشد. در مرحله Annealing و Extension، هم زمان با دو رشته شدن DNA، به آن متصل می شود و این اتفاق با افزایش سیکل ها افزایش می یابد. بنابراین نور فلورسنت بیشتری در هر سیکل ساطع می شود و توسط دستگاه اندازه گیری می گردد.
روش غیر اختصاصی Real Time PCR
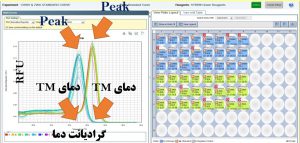
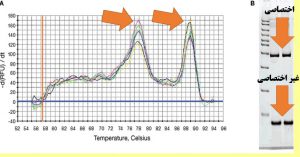
آنالیز منحنی ذوب (Melt Curve Analysis): از جمله مزایای Real Time PCR ترسیم منحنی ذوب است که این عمل پس از اتمام فرآیند تکثیر انجام می شود. دمای ذوب DNA یک پارامتر ویژه برای این مولکول می باشد و به چند عامل طول، تعداد نوکلئوتید، غلظت پروب، میزان نمک محیط و درصد GC بستگی دارد.
از آنجایی که SYBR Green نمی تواند بین محصولات مختلف تفاوتی قائل شود، می توان با استفاده از Melt Curve تنوع محصولات را در فرآیند PCR مشخص کرد.
در نقطه ذوب (TM) 50% پیوندهای هیدروژنی در DNA های دو رشته ای از هم جدا شده و میزان فلورسانس بطور ناگهانی تغییر می یابد.
روش اختصاصی Real Time PCR
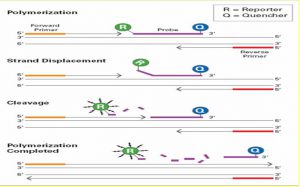
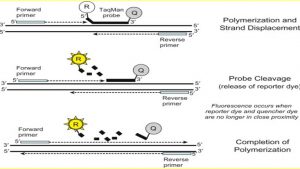
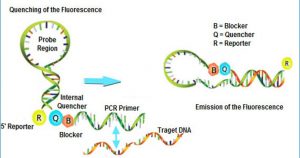
تفاوت پروب در این است که یک رنگ فلورسانت بنام Reporter در 5 پریم و رنگ فلورسانت دیگری در 3 پریم به نام Quencher قرار داده می شود.
هنگامی که Reporter و Quencher در فاصله نزدیک از هم قرار بگیرند (حالت عادی و اتصال به پروب)، نوری که به Reporter می خورد باعث ایجاد Emission می شود، توسط Quencher جذب شده و در طول موج بلندتر ساطع می کند که توسط دستگاه جذب نمی گردد و قابل ارزیابی نیست.
اما بلافاصله بعد از جدا شدن Reporter و Quencher از هم (در هر سیکل تکثیر) نور ساطع شده توسط Reporter توسط Quencher جذب نمی شود و این نور توسط دستگاه به صورت فلورسانس جذب و اندازه گیری می شود.
شکل زیر فعالیت Reporter در 5 پریم وQuencher در 3 پریم را نشان می دهد، که با چه مکانیسمی Reporter نور ساطع کرده و دستگاه، خوانش را انجام می دهد.
Taq Man Probe: Reporter در انتهای 5 پریم وQuencher در انتهای 3 پریم وجود دارد. همچنین یک بلاکر هم در انتهای 3 پریم وجود دارد که این بلاکر باعث می شود پروب به عنوان پرایمر استفاده نشود. در این حالت پروب چند باز بعد از انتهای 3 پریم پرایمر Forward طراحی می شود.
معمولاً طول این پروب 20 تا 30 نوکلئوتید است و آنزیم بعد از نزدیک شدن به پروب با استفاده از خاصیت Exonuclease Activity 5 پریم آنها را تجزیه می کند.
وقتی پروب تجزیه شد ماده Reporter از تاثیر Quencher خارج شده و از خود فلورسانس ساطع می کند.
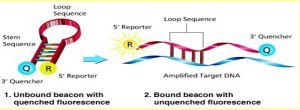
Beacon: این پروب نیز مانند Taq Man در انتهای 3 پریم و 5 پریم دارای رنگ می باشد.
اما بر خلاف Taq Man تجزیه نمی شود و در سیکلهای بعدی دوباره مورد استفاده قرار می گیرد. این پروب قبل از اتصال به DNA بصورت لوپ است که به آن Stem loop Structure می گویند. پس از اتصال پروب به محل مورد نظر ساختار باز می شود و نور ساطع می گردد.
روش اختصاصی Real Time PCR
Scorpion Primers: توالی پروب طوری است که مکمل تعدادی از نوکلئوتیدها بعد از پرایمر Forward است. دو طرف پروب شامل توالی شش نوکلئوتیدی است، که در دمای محیط ایجاد duplex می نماید. انتهای 5 پریم ساقه به صورت کووالانسی به Reporter و انتهای 3 پریم به Quencher متصل می باشد.
هنگامی که پروب به صورت duplex می باشد، نور ساطع نمی شود. یک بلاکر نیز از تکثیر پروب توسط پرایمر Reverse در چرخه بعدی PCR جلوگیری می کند. پروب بصورتی است که انتهای 5 پریم آن مکمل انتهای 3 پریم تارگت می باشد.
در طول سیکلهای PCR، همزمان با اتصال پرایمرها، لوپ پروب باز و به قسمت تکثیر شده از چرخه قبل متصل می شود و در نتیجه به علت جدا شدن Reporter از Quencher نور ساطع می شود.
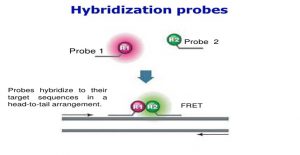
Hybridization Probes: در این نوع پروب بصورت دو قطعه مختلف طراحی می شود. فلورسانت در انتهای 5 پریم یکی و در انتهای 3 پریم دیگری قرار دارد. وقتی که این دو دقیقاً در محل مورد نظر خودشان بچسبند نزدیکی فاصله این دو ماده باعث واکنشی بنام FRET می شود.
انتخاب رنگها در این پروب به صورتی است که طول موج ساطع شده از یکی بعنوان محرک دیگری عمل می کند. پس از چسبیدن دو پروب این رنگها به هم نزدیک شده و فلورسانس ساطع شده قابل اندازه گیری است. طراحی این پروبها به نحوی است که در صورت تفاوت، حتی در یک نوکلیوتید پروب به DNA متصل نمی شود.
یکی از کاربردهای اصلی این نوع پروب برای تشخیص SNP می باشد. در شکل زیر نشان می دهد که پروب به صورت دو قطعه مختلف طراحی می شود. فلورسنت در انتهای 5 پریم و در انتهای 3 پریم دیگری قرار دارد.
Multiplex-Real Time PCR
Multiplex Real time PCR: استفاده از پروب و امکان انتخاب رنگهای مختلف می توان Multiplex Real time PCR را انجام داد. در این حالت برای هر هدف مورد نظر باید یک پروب انتخاب نمود، که طول موج هر کدام با یکدیگر متفاوت است.
روشهای تعیین کمیت با Real time
یکی از مهمترین کاربردهای Real time PCR تعیین کمی مقدار ژن بیان شده است، که به دو روش صورت می گیرد:
- کمیت سنجی مطلق (Absolute Quantification)
- کمیت سنجی نسبی (Relative Quantification)
- کمیت سنجی مطلق: تعداد دقیق کپی های یک ژن (Copy Number) مشخص می گردد. برای این کار به منحنی استاندارد نیاز می باشد. منحنی استاندارد بر اساس مقدار معلوم همان ژن و Threshold Cycle هر نمونه رسم می گردد.
- کمیت سنجی نسبی: یکی از کاربردی ترین استفاده های Real time PCR بررسی بیان ژنهاست که با استفاده از کمیت سنجی نسبی انجام می شود. در حال حاضر Relative Quantification دقیق ترین روش برای بررسی تغییرات بیان ژن است.
در این روش، تعداد مهم نیست و فقط کاهش یا افزایش بیان ژن مهم است، که در این تغییر بیان را با یک نمونه استاندارد یا ژن Reference مقایسه می شود. استاندارد مذکور بعنوان کنترل داخلی در نظر گرفته می شود که به آن House Keeping Gene گفته می شود.
در روش کمیت سنجی نسبی دانستن غلظت دقیق نمونه ها لازم نیست. این روش از نظر اقتصادی و زمانی بصرفه بوده و می توان در آن از cDNA، RNA، DNA ژنومی و یا حتی DNA کلون شده استفاده کرد.
اساس این روش بر پایه تعیین نسبت بیان ژن مورد نظر به ژن مرجع است. پردازش اطلاعات در Real time PCR بسیار حائز اهمیت می باشد. پردازش بر اساس نمودار استاندارد و ارزیابی بازده PCR می باشد.
در صورتی که در Absolute Quantification نمودار استاندارد حائز اهمیت است. برای بررسی و محاسبه بیان ژن مورد نظر و ژن مرجع به روشهای ریاضی متعددی نیاز می باشد.
کمیت سنجی نسبی PCR Real time
اختصاری از روشPfaffl : در این روش تعیین مقدار بیان ژن و نرمالایز کردن آن با یک ژن مرجع انجام می شود. نرمالایز کردن به منظور تصحیح و حذف اختلافهای موجود در تکثیر، شرایط تخلیص و مقدار حجم اولیه نمونه صورت می گیرد.
در این روش مقدار بیان در نمونه مورد نظر قبل و بعد از تیمار اندازه گیری و اختلاف Ct آنها محاسبه می شود. سپس همین مراحل بر روی نمونه مرجع نیز انجام می شود. حال می توان تغییرات بیان ژن مورد نظر را به تغییرات بیان ژن مرجع تقسیم کرد.
اختصاری از روش ΔΔCt: در این روش با فرض اینکه Efficiency ژن مورد نظر و مرجع با هم برابر در نظر گرفته می شود. بنابراین نسبت ژن مورد نظر و ژن مرجع را قبل و بعد از Treatment بدست آورده و بر هم تقسیم می کنیم.
آشنایی با مفاهیم در Real time PCR
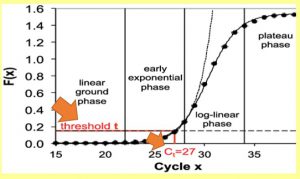
Baseline rgion یا Linear-ground phase: در این مرحله هنوز تکثیری صورت نگرفته و هیچ نوری ساطع نمی شود تا دستگاه آن را تشخیص دهد.
liner phase و Exponential phase: در این مرحله محصول دو رشته ای در هر چرخه PCR، دو برابر می شود و رشد تصاعدی مربوط به واکنش آغاز می شود.
Plateau phase: ترکیبات واکنش از بین می روند و افزایش در میزان فلورسنت مشاهده نمی شود. بنابراین میزان محصول PCR و نور فلورسنت ثابت می ماند.
مفهومCt و threshold: سیکلی که در آن واکنش وارد فاز exponential می شود را به عنوان سیکل مرجع در نظر گرفته و در تکنیک real time به این سیکل مرجع به اصطلاح سیکل آستانه یاCt (cycle of threshold) گویند. در شکل زیر حد آستانه را ورود به فاز exponential در نظر گرفته می شود و به مفهوم سیکلی است که در آن محصولات real time از یک حد آستانه فراتر رفته است.
منحنی ذوب Melt Curve: هر ژن یا محصول PCR دارای منحنی ذوب خاص خود در واکنشReal time میباشد. بنابراین تمام منحنی های یک ژن در تمام نمونه ها باید با هم منطبق باشند به شکل های زیر توجه کنید. منحنی ذوب برای هر محصول PCR باید دارای یک Peak باشد. A: قابل قبول B: تعدادی غیر قابل قبول
House Keeping Gene : در موردReal-time PCR شاخص هایی وجود دارد که لازم است در حین انجام PCR مورد توجه و کنترل قرار گیرند. این شاخصها شامل:
- مقدار اولیه نمونه ها
- غلظتRNA موجود در نمونه
- کارایی ساختcDNA و تفاوتها در فعالیت نسخه برداریهای کلی در بافتها و سلولهای مورد تجزیه و تحلیل است.
برای بدست آوردن نتایج دقیق باید سطوح بیانی ژنهای هدف به وسیله ژنهای کنترل داخلی، که تحت شرایط مختلف بیان ثابتی دارند و به اصطلاح ژنهای Housekeeping نامیده میشوند، نرمال سازی گردند.
ویژگی های House Keeping Gene:
- در همه سلولها Copy number یکسانی داشته باشد.
- در همه سلولها بیان شود.
- بیان ژن مرجع و ژن مورد نظر باید متناسب با هم باشند. اگر ژن مورد نظر به میزان کم بیان می شود، نباید ژن مرجعی را انتخاب کنیم که بیان آن زیاد است. در این صورت مقایسه یک مقدار کم با مقدار زیاد باعث افزایش خطای کار می شود.
- از تیمارهایی که بر روی نمونه شده است نباید تاثیر بپذیرد.
House Keeping Gene که بطور معمول استفاده می شوند:
- B-actin mRNA 2. MHC I 3. Cyclophilin
- 28S or 18S rRNA 5. GAPDH
نمودار و گراف های Real time PCR
با استفاده از داده ها مي توان تفاوت ها، شباهت ها و تغييرات در اعداد و ارقام را شناسايی و نشان داد. ولی داده ها به خوبی تصاوير، مقصود نظر را بيان نمی كنند. به كمك نمودارها، داده ها به شكل تصويري نمايش داده می شوند.
نمودار، يك نمايش گرافيكي از داده هاست كه با استفاده از آن به راحتي ميتوان داده ها و اطالعات را تجزيه و تحليل كرده و مقايسه هاي آماري انجام داد. برنامه های صفحه گسترده براي بررسی و كار بر روي داده ها ايجاد شده اند و امكان ايجاد نمودار يكي از ابزارهای مهم در آنها می باشد. تعداد نرم افزارهایی که از آنها برای آنالیز داده ها استفاده می شود بسیار متنوع است و از جمله آنها می توان به SPSS، GraphPad، R و… اشاره نمود که قابليتها و امكانات متنوعی برای رسم نمودارها در اختيار كاربر قرار مي دهند.